国立大学法人熊本大学
【ポイント】
-
ショウジョウバエでの生殖質形成を促進する新規母性因子Tppが、トランスポゾン抑制に関与するpiRNAの産生に関わる因子であることが明らかになりました。
-
Tppを欠いた卵巣では、piRNA産生量が減少し、その結果PIWIタンパク質の1つであるAubergineタンパク質の生殖質への局在が不全となり、次世代の生殖細胞形成が阻害されることが明らかになりました。
-
piRNAがトランスポゾン抑制に必要な量よりも過剰に産生されることにより、次世代の生殖細胞においてトランスポゾンによるゲノム損傷を防ぎ、世代を超えて遺伝情報の正確性を保証するメカニズムが存在することが明らかにされました。
【概要説明】
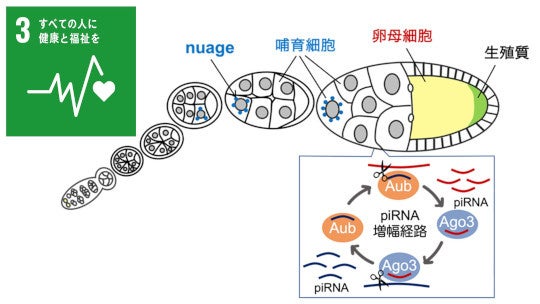
生殖細胞は、次世代に遺伝情報を伝えることができる唯一の細胞です。したがって、生殖細胞のゲノム情報を守ることは、生物にとって極めて重要な使命といえます。特に、トランスポゾン(注1)と呼ばれる動く遺伝子の活性化は、遺伝情報の破壊につながる恐れがあるため、生殖細胞にはこれを抑制するpiRNA(PIWI-interacting RNA)と呼ばれる小分子 RNAが備わっています。piRNAは、PIWIタンパク質と複合体を形成し、トランスポゾンの発現を抑制する働きを担っています。ショウジョウバエにおいて、このpiRNAの配列情報は母から子へと受け継がれ、世代を超えて生殖細胞のゲノム情報を守る仕組みとして機能します。
熊本大学発生医学研究所の中村輝教授、東京大学定量生命科学研究所の泊幸秀教授、喜納寛野助教(研究当時:熊本大学大学院薬学教育部博士課程)らの研究チームは、ショウジョウバエを用いた研究から、生殖細胞の形成とpiRNAの生合成を制御する新規因子Tpp(Tiny pole plasm)を同定しました。TppはAubergineタンパク質(Aub)を介して、piRNAの合成と次世代への伝承、そして生殖細胞の形成を密接に結びつける役割を担います。
本研究では、Tppを欠損した卵巣において、Aubが卵母細胞の後極に効率的に局在できず、生殖細胞形成に必要な生殖質(注2)が正しく形成されないことが明らかになりました。また、Tppが卵巣におけるpiRNAの生合成を促進し、PIWIファミリータンパク質のひとつであるAubへのpiRNAの結合を助ける役割を担うことが明らかになりました。予想に反して、Tpp を欠損させた卵巣では Aubと結合したpiRNAの量が減少しているにもかかわらず、トランスポゾンの発現はほぼ正常に抑制されていました。この結果は、通常の卵巣ではpiRNAが必要量を上回って存在する可能性を示唆しています。このような過剰なpiRNAは、次世代への情報伝達や生殖細胞形成において重要な役割を果たしていると考えられます。
本成果は、piRNA経路がゲノム防御に加えて生殖細胞形成を支える新たなメカニズムを提案します。今後、他の動物種における普遍的な仕組みとしての解明が期待されます。
[背景]
生殖細胞は、卵や精子といった配偶子を生み出し、遺伝情報を次世代へと伝える役割を担っています。そのため、生殖細胞ゲノムの配列情報を守ることは、種の存続にとって非常に重要です。このゲノムの安定性を脅かす要因のひとつがトランスポゾン(動く遺伝子)です。トランスポゾンは、活性化するとゲノム上のさまざまな場所へと挿入され、遺伝情報の破壊をもたらします。こうした脅威に対抗するため、生殖細胞にはpiRNAと呼ばれる小分子RNAによる防御機構が備わっています。piRNAは、過去に侵入したトランスポゾンの配列に対応する情報を持ち、PIWIファミリータンパク質と複合体を形成することで、標的となるトランスポゾンmRNAを認識・切断し、その発現を抑制します。
ショウジョウバエでは、nuageと呼ばれる非膜性のオルガネラが、piRNA生合成の場として知られています。nuageでは、PIWIファミリータンパク質であるAubとAgo3(Argonaute3)がトランスポゾン由来のRNAなどを切断することにより、トランスポゾンの発現を抑制します。さらに、AubとAgo3は切断されたRNA断片を互いに受け渡し、それを元にしてpiRNAを生成することで、piRNAの増幅も行います。このようなpiRNA増幅経路のことをピンポン経路(注3)と呼びます。
一方、Aubは卵母細胞の後極の生殖質にも局在し、生殖質タンパク質として生殖細胞の形成に寄与します。生殖質は、母性由来のタンパク質やRNAから構成され、胚発生の過程で生殖質を取り込んだ細胞が将来の生殖細胞となります。興味深いことに、AubはpiRNAと結合した状態で生殖質に局在し、次世代の生殖細胞へと受け継がれ、この母性由来のpiRNAは、子の世代におけるpiRNA生合成のテンプレートとして用いられると考えられています。
このように、Aubは卵巣内におけるトランスポゾンの抑制のみならず、生殖細胞の形成やpiRNA情報の継承を通じて種の維持に貢献しています。また、Aub以外の主要な生殖質タンパク質もnuageに局在しています。以上のことから、nuageにおけるpiRNAの生合成と生殖質の形成には協調的な関係があると予想されますが、両者の関係は不明でした。
[研究の内容]
本研究では、ショウジョウバエを用いて、CRISPR-Cas9システムによる機能未知遺伝子のノックアウトスクリーニングを行い、生殖細胞数の減少を引き起こす新規の母性因子としてtppを同定しました。tppを欠いたメスが産んだ胚では、生殖細胞の数が著しく減少していました。
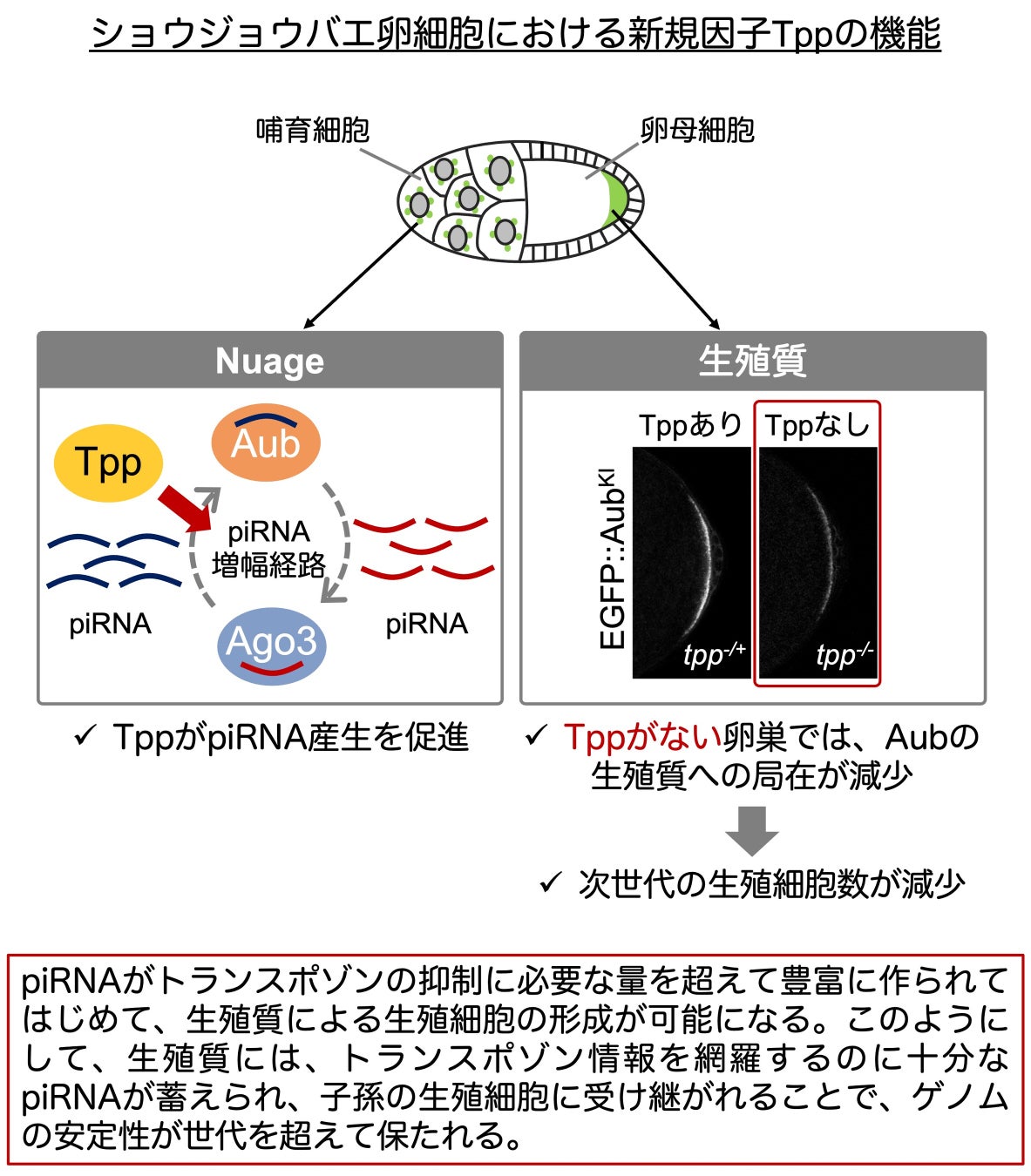
解析により、tpp変異卵巣では、生殖質タンパク質であるAubの卵母細胞後極(生殖質領域)への局在が特異的に減少することにより、生殖細胞の形成が阻害されることが明らかになりました。Aubは、卵巣において生殖質とnuageの両方に局在します。一方、Tppは生殖質には局在せず、nuageにおいてのみAubと共局在していました。これにより、TppがnuageにおいてAubと相互作用し、piRNAの生合成に関与している可能性が示唆されました。
実際、tpp変異卵巣においてはAubと結合するpiRNA量が大きく減少していました。そこで、Aubの生殖質への局在がpiRNAとの結合に依存するかを検証するため、piRNAとの結合能が低下する変異を導入した変異型Aubを持つハエ個体を作製しその局在を観察しました。その結果、piRNAと結合しにくい変異型Aubの生殖質領域への局在は著しく減少していることが明らかになりました。以上の結果から、piRNAを持たない「空のAub」は、生殖質に局在しにくい可能性が示唆されました。したがって、tpp変異卵巣では、piRNAを持たない空のAubが増加することにより、Aubの生殖質への局在が低下すると考えられます。
興味深いことに、tpp変異体においてpiRNA量が大きく低下しているにもかかわらず、卵巣内ではトランスポゾンの発現がほぼ正常に抑制されていました。これは、通常状態において、piRNAがトランスポゾンの抑制に必要な量を超えて豊富に存在していることを意味します。AubがpiRNAと結合した状態で生殖質に局在し、そこから次世代の生殖細胞へと受け継がれることを踏まえると、過剰なpiRNAは、トランスポゾン情報を網羅的に蓄積した記憶媒体として、それを子の世代へと伝える役割を担っている可能性があります。すなわち、生殖質の機能や次世代のゲノム防御を保証するという観点から、piRNAが必要な量を超えて産生されること自体が、生殖細胞形成と種の存続において重要な意味を持つ可能性があります。
[展開]
本研究の成果は、piRNAの生合成と生殖細胞形成が密接に連携していることを示す新たな手がかりを提供します。Tppを介したこの協調的な制御機構の発見により、piRNA経路がトランスポゾン抑制にとどまらず、生殖細胞の形成そのものを促進する役割を持つことが明らかになりました。これにより、ゲノム情報を適切に保護できる個体が生殖細胞を形成し、次世代を紡いでいくという、種の存続に関わる新たな視点が提案されます。さらに、このようなシステムは他の動物種にも普遍的に存在する可能性があり、piRNAと生殖細胞の関係における今後の研究の発展が期待されます。
[用語解説]
(注1)トランスポゾン:ゲノム上を移動できる遺伝子。活性化されると、ゲノム内の無作為な位置に挿入され、既存の遺伝情報を損なうリスクがある。
(注2)生殖質:ショウジョウバエを含む多くの動物種では、卵の中の生殖質と呼ばれる特殊な細胞質領域が存在し、これを取り込んだ細胞が将来の生殖細胞となる。
(注3)ピンポン経路:piRNA生合成経路のひとつで、ショウジョウバエにおいてはPIWIファミリータンパク質であるAubとAgo3が協調して機能する。AubとAgo3はそれぞれpiRNAと結合し、相補的な配列を持つトランスポゾンRNAを認識・切断することでその発現を抑制する。さらに、切断したRNA断片を別のPIWIタンパク質へと受け渡すことで、新たなpiRNAが生成され、この反応が繰り返されることでpiRNAが増幅される。
【論文情報】
論文名:Abundant piRNA production mediated by the Drosophila GTSF1 homolog Tpp ensures Aubergine localization and germ plasm assembly
著者:Hirono Kina, Natsuko Izumi, Kazuko Hanyu-Nakamura, Takashi Yoshitani, Mariko Yamane, Hitoshi Niwa, Yukihide Tomari, and Akira Nakamura
掲載誌:PNAS
doi:10.1073/pnas.2419375122
URL:https://doi.org/10.1073/pnas.2419375122
【お問い合わせ先】
(研究に関すること)
熊本大学発生医学研究所
担当:(教授)中村 輝(なかむら あきら)
電話:096-373-6569/6557
e-mail:akiran@kumamoto-u.ac.jp
(報道に関すること)
熊本大学総務部総務課広報戦略室
電話:096-342-3269
e-mail:sos-koho@jimu.kumamoto-u.ac.jp