株式会社ユーグレナ
-真核生物の新たな遺伝子発現の塩基配列ルール-
概要
理化学研究所(理研)環境資源科学研究センターバイオ生産情報研究チームの野村俊尚客員主管研究員(山形大学農学部准教授)、キム・ジュンシク研究員、持田恵一チームディレクター(最先端研究プラットフォーム連携(TRIP)事業本部藻類資源アップサイクル研究チーム副チームディレクター、長崎大学情報データ科学部教授、横浜市立大学木原生物学研究所客員教授)、東京大学大学院理学系研究科化学専攻の合田圭介教授、株式会社ユーグレナの鈴木健吾エグゼクティブフェロー(理研TRIP事業本部藻類資源アップサイクル研究チームチームディレクター)、鶴岡工業高等専門学校創造工学科基盤教育グループの伊藤卓朗准教授、高知大学農林海洋科学部の櫻井哲也教授らの共同研究グループは、真核生物の遺伝子発現において重要な過程であるmRNAスプライシング[1]において、ユーグレナ[2](和名:ミドリムシ)では、従来の真核生物で広く見られる配列ルールに加えて、全く異なるルールに従うイントロン[3]を多数併用していることを明らかにしました。
本研究は、従来型と非従来型の二つのイントロンが共存する生物種の実例を分子遺伝学的に示した初めての成果であり、ゲノム編集[4]による合成イントロンの導入と合わせることで、遺伝子機能の発現制御などへの応用が可能になると期待されます。
本研究は、科学雑誌『Proceedings of the National Academy of Sciences(PNAS)』オンライン版に9月22日の週に掲載されます。
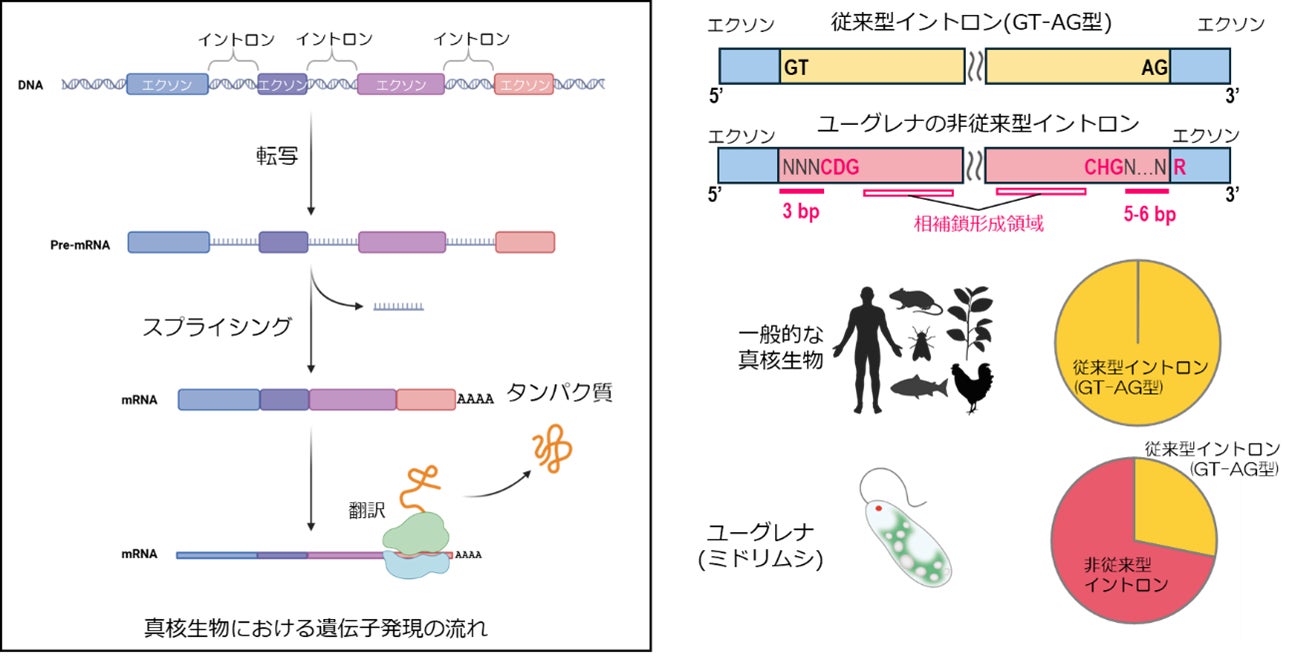
背景
私たちヒトを含む真核生物の遺伝子の多くは、タンパク質のアミノ酸配列などをコードするエクソン[3]と呼ばれる領域と、非コード領域としてmRNAのプロセッシングの過程でスプライシングという機構により除去されるイントロンと呼ばれる領域で構成されています。正確に遺伝子機能を発現するには、スプライシングを担うタンパク質が、ゲノムDNA上で正確にイントロンの領域を認識する必要があるため、一般的なイントロンの末端は、はじまりが「G(グアニン)T(チミン)(まれにGC(シトシン))」の2塩基で、終端は「A(アデニン)G」の2塩基で構成されています。この配列ルールにのっとっていないイントロンはまれであるため、「GT-AGルール」は真核生物の遺伝子発現機構における基本的なルールとして分子生物学の教科書に記載されるとともに、ゲノムDNA配列から遺伝子構造を探索する際の重要な目印となっています。
これまで、ユーグレナの一部の遺伝子では、GT-AGルールにのっとっていないイントロンが存在することが報告されていましたが、そうした非従来型のイントロンがゲノム上にどれくらい存在し、この非従来型のイントロンをスプライシングするための配列ルールが存在しているのかは明らかにされていませんでした。そのため、ユーグレナゲノムにコードされている遺伝子とその構造も十分に解明されていませんでした。そこで、本研究では、ユーグレナのイントロンをゲノムワイドに調査するとともに、非従来型のイントロンのスプライシングに必要な配列ルールの解明に挑みました。
研究手法と成果
今回、共同研究グループは、ユーグレナのゲノム上の遺伝子構造を網羅的に解析し、大半のイントロン領域のDNA配列が、教科書的に知られているGT-AGルールにのっとっていないことを見いだしました。GT-AGルールを逸脱した配列の特徴が、スプライシングに関与するかどうかを調べるために、これまでに開発したゲノム編集技術注)を用いて、塩基を書き換えた合成イントロンをユーグレナゲノム内に導入し、そのスプライシングの成否を確認する実験を重ね、これらの非従来型イントロンのスプライシングに必要なDNA配列の構成要素を解読しました。さらに、この構成要素を持つ完全に人工的なDNA配列をユーグレナに導入しても、正確にスプライシングを誘導できることを示しました。具体的な研究とその成果は次の通りです。
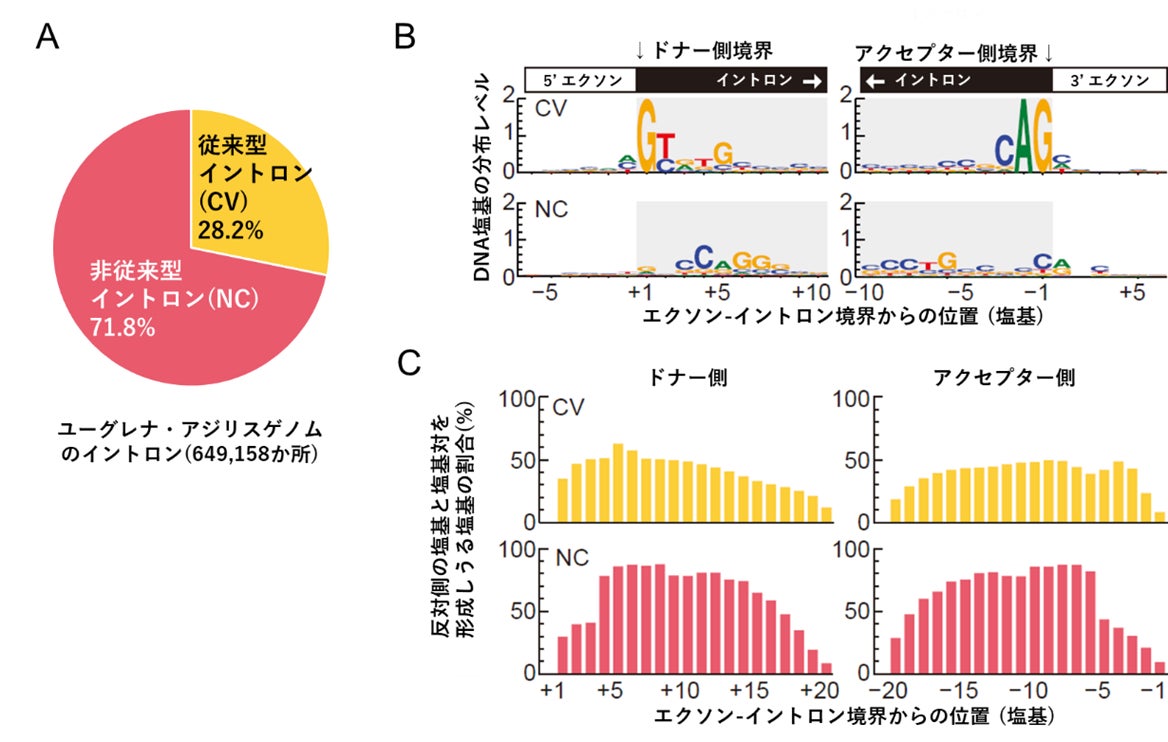
まず、共同研究グループは、ユーグレナ藻類の中で比較的ゲノムサイズが小さいとされるユーグレナ・アジリス(Euglena agilis)の全ゲノム解析とトランスクリプトーム(細胞内の全転写産物)解析による発現遺伝子の配列解読を行い、発現遺伝子の配列をゲノム配列にマッピングすることで、エクソン-イントロン構造を調べました。その結果、ゲノム上に見いだした約65万カ所のイントロンのうち、71.8%のイントロンがGT-AGルールから逸脱していることが示唆されました。このGT-AGルール逸脱型イントロン(非従来型イントロン)とエクソンとの境界領域の配列を観察すると、いくつかの配列に特徴があることが示唆されました。
具体的には、①非従来型イントロンは開始側にCAGに富むモチーフ(保存的な配列)、終端側にCTGに富むモチーフを有する、②エクソン-イントロン境界から数えて、CAGモチーフの前に3塩基、CTGモチーフの前に5塩基の間隔がある、③イントロンの終端の隣の塩基(後ろ側エクソンの開始塩基)はプリン塩基[5](AまたはG)に富む、④CAGモチーフ、CTGモチーフからそれぞれイントロンの内側に向かって10塩基程度の塩基対を形成する相補配列[6]領域で構成されている、というものでした(図1)。
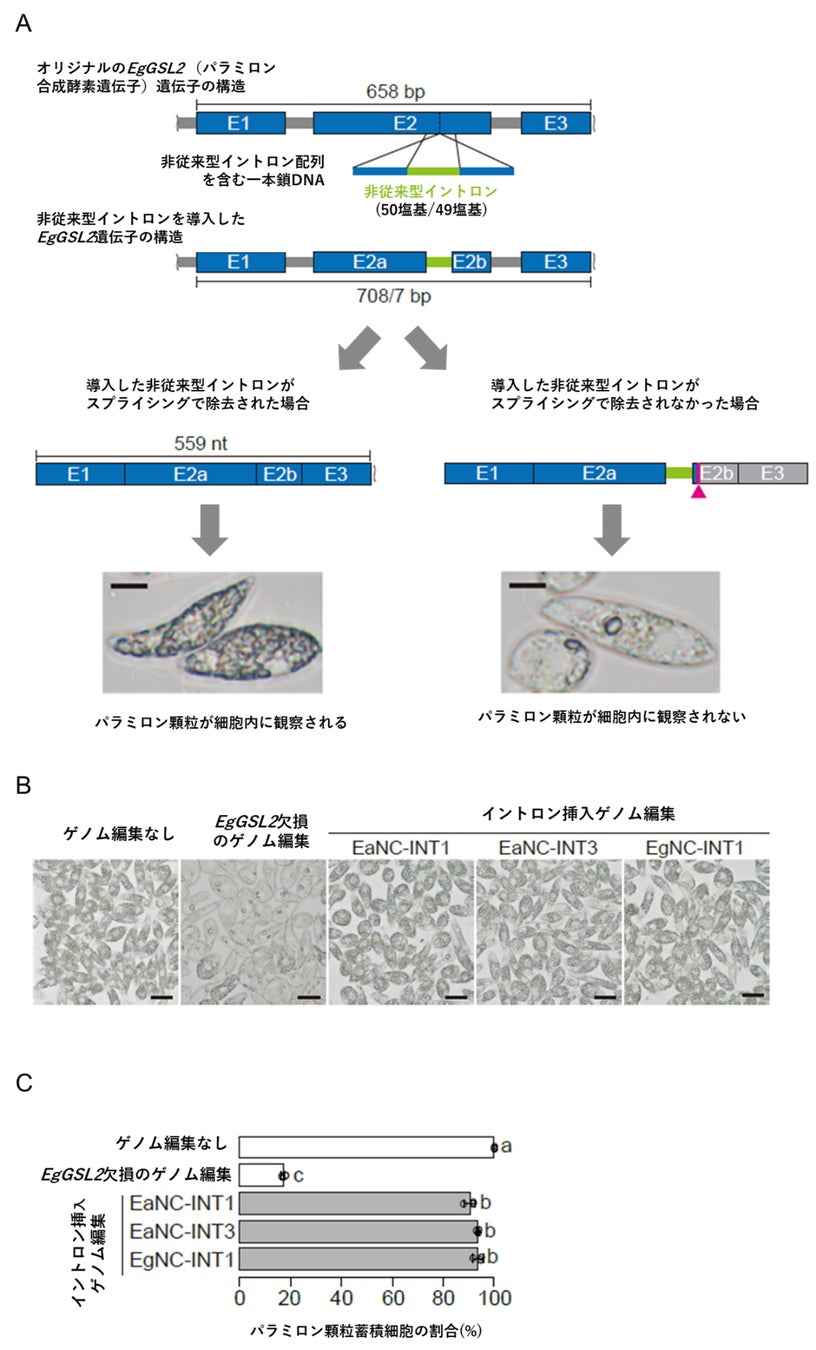
次に、これらの配列の特徴がユーグレナの非従来型イントロンのスプライシングの成否に関わるかを調べました。まず、ユーグレナ・アジリスのゲノム上から、50塩基程度の短いイントロン配列を見つけ、それらをゲノム編集によりユーグレナ・グラシリス(Euglena gracilis)のパラミロン(貯蔵多糖)合成に関わるEgGSL2遺伝子の第2エクソンに導入し、パラミロン顆粒(かりゅう)の蓄積とEgGSL2遺伝子から転写されたmRNAの配列を調べました。このユーグレナ・アジリス由来のイントロンを導入したグラシリス系統の細胞では、パラミロン顆粒の蓄積が観察されていました。また、これらの系統においては、EgGSL2遺伝子から転写されたmRNAの配列では、導入したユーグレナ・アジリスイントロンが正しくスプライシングを受けて除去されていました。従って、同様の現象は、グラシリスに由来する49塩基のイントロンでも再現することが可能でした。これらのことから、50塩基程度のDNA配列内に、ユーグレナの非従来型イントロンのスプライシングに必要な配列要素が含まれていることが示唆されました。また、これらのイントロンの塩基配列を人為的に改変してEgGSL2遺伝子に導入し、パラミロン顆粒の蓄積と関連性を調べることで、どの塩基配列の特徴がスプライシングに必要か調べることが可能になりました(図2)。
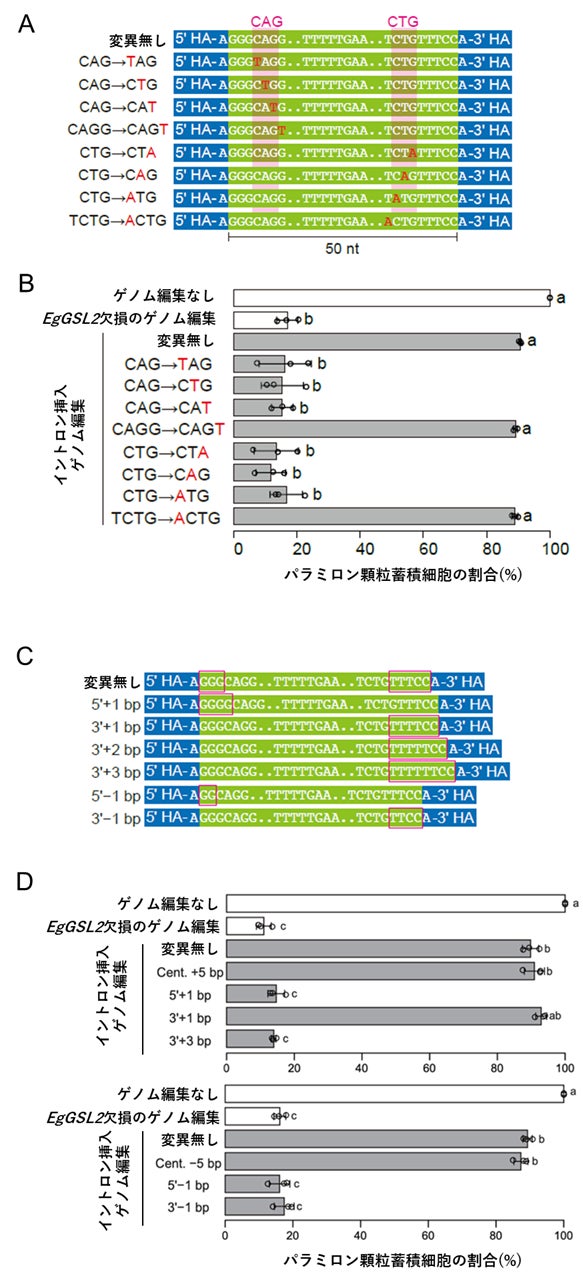
パラミロン顆粒の蓄積を指標としたスプライシングの評価方法を用いて、まず、イントロンの端部に特徴的なCAGとCTGのモチーフ配列がスプライシングに必要かを調べるため、天然イントロンのこの部分の配列を1塩基ごとに置換した合成イントロン配列をEgGSL2遺伝子に導入してスプライシングの成否を調べました。結果として、この3塩基のモチーフの塩基配列を変更するとスプライシングされなくなったことから、この塩基配列がスプライシングに必要であることが分かりました。
次に、前のエクソンの終端からCAGまでの塩基数とCTGから次のエクソンまでの塩基数にルール性があるかどうかを検証するため、それぞれの領域の塩基数を変えた合成イントロン配列をEgGSL2遺伝子に導入し、スプライシングの成否を調べました。すると、前のエクソンの終端からCAGまでは3塩基である必要があり、CTGから次のエクソンまでの塩基数は5塩基が最もスプライシング効率が高く、この塩基を1塩基ずつ減らすとmRNAの発現レベルが徐々に低下しました(図3)。これらのことから、イントロン上のCAGとCTGのモチーフ配列とエクソン間の塩基数もスプライシングに重要であることが分かりました。
さらに、イントロン後のエクソンの最初の塩基はAかG(プリン塩基)に偏っている点についても、他の塩基であるTやCに編集し、スプライシングとの関連を調べました。結果として、このエクソンの開始塩基もプリン塩基であることがスプライシングに必要であることが示唆されました。
そして、CAGモチーフ、CTGモチーフからそれぞれイントロンの内側に向かう10塩基程度の塩基対を形成する領域についてスプライシングにおける必要性を検証しました。そのために、これまでに判明したスプライシングに必要な配列要素とこの領域に相補配列を持つ人工イントロンと、この領域に相補配列がないイントロンをそれぞれ合成し、EgGSL2遺伝子に導入してスプライシングの成否を調べました。結果として、この相補配列領域の相補性をなくしたイントロンは、スプライシングされなかったことから、この領域の塩基配列の相補性も、ユーグレナの非従来型イントロンのスプライシングに必要であることが示唆されました。この実験で用いた合成イントロン配列は、ここまでの実験で明らかとなったスプライシングに必要と考えられる配列要素を組み合わせて設計した人工イントロン配列であることから、ユーグレナの非GT-AGイントロンのスプライシングに必要な配列要素が特定できたといえます(図4)。
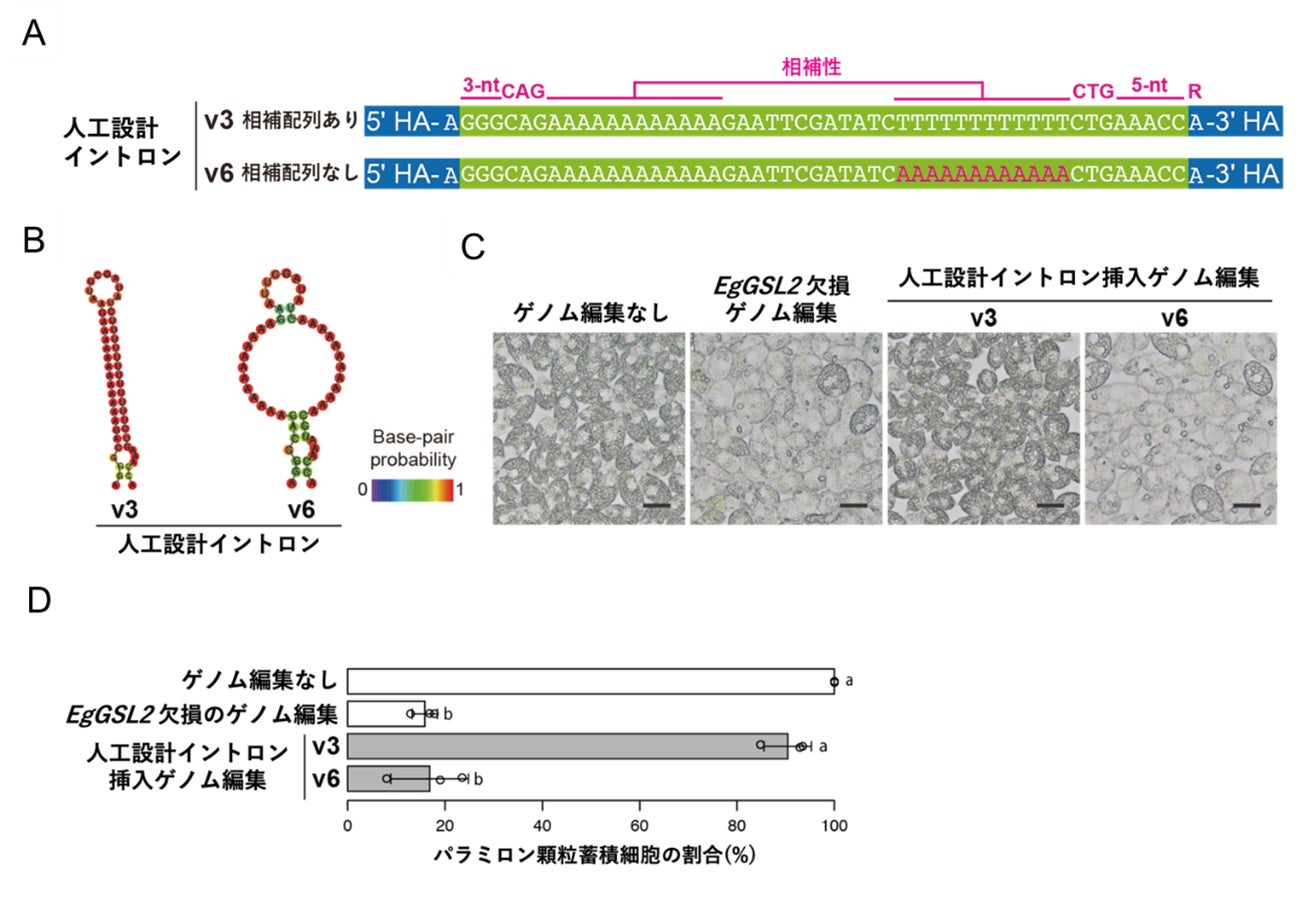
さらに、CAGとCTGのモチーフ配列の位置が入れ替わった、CTG-CAG型のイントロンもユーグレナ・アジリスのゲノム中に存在していました。このモチーフを入れ替えたイントロンを導入した場合も、スプライシングが可能であることが実験によって検証できたことで、それぞれのモチーフの中央のAとTは入れ替え可能であることが明らかになりました。
こうして解読された非GT-AGイントロンの配列ルールに基づいて、ユーグレナ・アジリスの遺伝子構造を再評価しました。その結果、従来型のGT-AGルールにのっとったイントロンが28.2%であり、非従来型でCAG-CTGモチーフとその派生型を含む配列ルールに従うイントロンは54.2%に上りました(両者の特徴を持つイントロン0.8%を含む)。依然として不確かなエクソン-イントロン境界を持つイントロンは全体の17.7%であり、ユーグレナのゲノムの半分以上のイントロンが、本研究で明らかになったイントロンの配列ルールにのっとっていることが示唆されました。
注)2019年6月17日プレスリリース「ミドリムシでの高効率ゲノム編集に成功」
https://www.riken.jp/press/2019/20190617_1/
今後の期待
本研究により、真核生物の遺伝子発現機構において、常識的なGT-AGルールとは全く異なるスプライシングのためのイントロン配列ルールがユーグレナの多くの遺伝子で採用されていることが明らかになりました。
研究の出発点は、ユーグレナの遺伝子構造を網羅的に調べた際に、GT-AGルールに基づくゲノム解析に用いるソフトウエアでは、遺伝子構造をほとんど見つけることができない問題に出合ったことでした。また、ユーグレナのゲノム編集により塩基書き換えや正確な配列導入が可能になったことで、イントロンの塩基の重要性を1塩基単位で検証することが可能になりました。
本研究でスプライシングの可否を調べたユーグレナ・グラシリスは、健康食品やバイオ燃料の原料として利用が進む微細藻類であり、遺伝子構造の正確な理解はゲノム編集による改良に不可欠です。本成果は、ユーグレナにおける有用物質の生産に関わる代謝経路の同定や改変を可能にするとともに、二酸化炭素の固定と資源化を目的としてバイオマスの生産性を向上するための形質の改良につながると期待されます。
本研究成果は、国際連合が定めた17の目標「持続可能な開発目標(SDGs)[7]」のうち、「13.気候変動に具体的な対策を」「2.飢餓をゼロに」「7.エネルギーをみんなにそしてクリーンに」に貢献するものです。
補足説明
[1] スプライシング
mRNAからイントロン([3]参照)を取り除き、エクソン([3]参照)をつなぎ合わせる細胞内での遺伝情報の編集過程のこと。1塩基でもずれると正常なタンパク質ができないため、生命にとって極めて重要なプロセスであり、非常に精密に制御されている。同じ遺伝子から複数の異なるタンパク質をつくり出すことも可能にしている。
[2] ユーグレナ
ユーグレナ属の微細藻類の一種で、植物と動物の両方の特徴を持つ珍しい単細胞生物。植物のように光合成を行う一方で、動物のように鞭毛(べんもう)で泳ぎ回ることもできる。池や沼に広く生息し、生物の進化を理解する上で重要な原始的な真核生物として研究されている。近年では健康食品やバイオ燃料の原料としても注目を集めている。和名はミドリムシ。
[3] イントロン、エクソン
遺伝子は「エクソン」(タンパク質の設計図として使われる部分)と「イントロン」(最終的には使われない部分)で構成されている。遺伝子からタンパク質がつくられる際、まずmRNAにDNAの塩基配列の情報が転写され、その後イントロンが取り除かれてエクソンがつなぎ合わされ、成熟したmRNAができる。この仕組みにより、エクソンのつなぎ方を変える選択的スプライシングにより同じ遺伝子から異なるタンパク質をつくることも可能になる。
[4] ゲノム編集
生物のDNA(遺伝情報)を人工的に正確に改変する技術。CRISPR-Cas9などの最新技術により、狙った遺伝子の特定部位を切断・修正できる。医療での遺伝性疾患治療や、農業での品種改良などに応用されている。一方で、倫理的課題や安全性について社会全体での議論も重要とされている。
[5] プリン塩基
DNAやRNAを構成する核酸塩基はA(アデニン)、C(シトシン)、G(グアニン)、T(チミン)、U(ウラシル)の5種類があり、その基本構造から二つに分類され、AとGをプリン塩基、C、T、Uをピリミジン塩基という。
[6] 相補配列
DNAやRNAを構成する塩基は、特定の組み合わせで水素結合をつくりやすい性質がある。この「対になる関係」を相補性という。DNAでは、AとT、GとCがそれぞれ相補的に結合する。RNAでは、AとU、GとCが相補的に結合する。一本鎖のRNAの一部が折り畳まれてヘアピンのような2次構造をつくることがあり、その際も相補配列が結合して構造をつくる。
[7] 持続可能な開発目標(SDGs)
2015年9月の国連サミットで採択された「持続可能な開発のための2030アジェンダ」にて記載された2016年から2030年までの国際目標。持続可能な世界を実現するための17の目標、169のターゲットから構成され、発展途上国のみならず、先進国自身が取り組むユニバーサル(普遍的)なものであり、日本としても積極的に取り組んでいる(外務省のホームページから一部改変して転載)。
論文情報・共同研究グループ・研究支援の情報については、理研HPをご参照ください。